![]()
第88回(2003.3) 薬剤師国家試験問題の正解と解説
- 医療薬学総論 - by shimo
| 問 211 | 医薬品の品質、有効性及び安全性を確保するために定められている諸基準の略語に関する記述のうち、正しいものの組合せはどれか。 | ||||||||||||||||||||||||
a GCPとは「医薬品の臨床実験の実施の基準」である。 b GPMSPとは「医薬品の市販後調査の基準」である。 c GMPとは「医薬品の安全性に関する非臨床試験の実施の基準」である。 d GLPとは「医薬品及び医薬部外品の製造管理及び品質管理の基準」である。 |
|||||||||||||||||||||||||
| 選択肢 | 1(a、b) 2(a、c) 3(a、d) 4(b、c) 5(b、d) 6(c、d) | ||||||||||||||||||||||||
| キッカケ | 英語の意味を知れば、間違えることはない。例えば、clinicalは「臨床の」、post-marketingは「市販後」のことである。 | ||||||||||||||||||||||||
| 解説 | ○a 正しい。(good clinical practice) ○b 正しい。(good post-marketing surveillance practice) ×c GMPは「医薬品及び医薬部外品の製造管理及び品質管理の基準」である。 ×d GLPとは「医薬品の安全性に関する非臨床試験の実施の基準」である。ようするにcとdの解説が逆になっている。 |
||||||||||||||||||||||||
| ポイント | ◆GMP ( god manufacturing practice:薬局等構造設備規則、医薬品および医薬部外品の製造管理及び品質管理規則) ◆GLP ( good laboratory practice :医薬品の安全性に関する非臨床試験の実施の基準) ◆GCP ( good clinical practice :医薬品の臨床試験の実施の基準) ◆GPMSP (good post-marketing surveillance practice :医薬品の市販後調査の基準) ■キーワード ◆GMP (GMPは、製造業者の許可用件である。製造管理、品質管理の方法に不備があれば、業務停止措置がとられることになる。GMPに則った医薬品の製造を行わなければならない。) ◆GLP (GLPは、新医薬品の承認申請等のために行われる有効性・安全性に関する非臨床試験(実験動物を用いた試験)データの信頼性を高めるための試験実施上の基準。非臨床試験の実施にあたって遵守すべきハード、ソフト面での基準を定めたものである。一般毒性試験のほか、生殖・発生試験・がん原性試験・依存性試験などの特殊毒性試験も対象となっている。 |
||||||||||||||||||||||||
| 正解 1 | |||||||||||||||||||||||||
| これで完璧!! | 動物実験の段階ではGLP(医薬品の安全性試験の実施に関する基準)、臨床試験ではGCP(医薬品の臨床試験の実施に関する基準)、製造段階ではGMP(医薬品の製造管理及び品質管理に関する基準)、市販後はGPMSP(医薬品市販後調査実施基準)など医薬品開発の各段階で安全確保のための対策がとられている。 |
||||||||||||||||||||||||
| 問 212 | 保険医療機関(病院)や保険薬局における医薬品の流通過程に関して、内に入る語句の正しい組合せはどれか。 |
||||||||||||||||||||||||
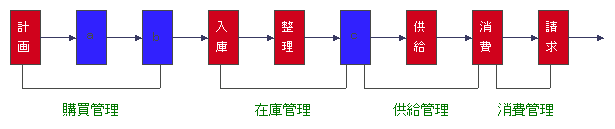 |
|||||||||||||||||||||||||
| 選択肢 |
|
||||||||||||||||||||||||
| キッカケ | 流通過程については、丸暗記するよりも、頭の中で、どのようなことを行うべきか順を追って考えれば、おのずと答えが導き出せる。 製薬企業による医薬品の回収は依頼は頻繁にあるが、その場合も該当するロット番号の製品が回収される。 ロット管理はリスクマネージメントの観点からも重要である。患者さんから、以前間違った薬を渡されたとクレームがある場合もあるが、ロット番号を調べてみると、異なる医療機関から受け取った医薬品であったり、何年も前の医薬品であったりすることが確認でき、こちら側の正当性を証明できることが多い。 |
||||||||||||||||||||||||
| 解説 | 注文することを「発注」という。1ヶ月分まとめて購入する場合と、足りない分をその都度発注する場合がある。最近はオンライン発注が行われることが多い。医薬品卸のMS(営業担当者)が薬局へ納品した際に、使用期限や、ロット番号などを確認し、適正な医薬品が納品されているか検査する行為を「検収」という。「入庫」した医薬品は医薬品倉庫に保管する。これはまだ、返品可能である。調剤室に「出庫」して、箱からあけてしまえばもはや返品はできない。 |
||||||||||||||||||||||||
| ポイント | 在庫を増やせば、欠品が少なくなるが、コストがかかるし、デッドストック(有効期限切れのために廃棄する医薬品)も増加する。在庫を減らせば、コストはかからないが、緊急時の対処が不可能であったり、欠品を生じ患者さんからの信用を失うことにもつながる。医薬品購入担当者は適正な在庫を確保することが求められる。 ■キーワード 医薬分業も50%時代を迎え、医薬品卸は急増する取引先である調剤薬局に対し新しい取り組みを行っている。例えばクラヤ三星堂は、ITを活用した新しいビジネスモデル「medks‐epi」をスタートさせた。福神は、都市型物流センターを活用し定時配送などを通じて調剤薬局を支援しようとしている。東邦薬品は、顧客に焦点を当てた新しい受発注システム「ENIF」に「分割販売」「情報」といった機能を組み合わせた会員組織「ENIFクラブ」を展開している。 |
||||||||||||||||||||||||
| 正解 4 | |||||||||||||||||||||||||
| これで完璧!! | ◆主な薬品管理業務 ・発注検収管理 ・適正在庫量の管理 ・品質管理、使用期限の管理 ・麻薬、向精神薬等の管理 ・OTC、衛生材料等の在庫管理----保険薬局の場合 ・治験薬、特殊薬品等の管理-----病院薬剤部の場合 [購入管理〕 必要な医薬品を、納入業者(医薬品卸業者)に発注する。医薬品の納品に際しては検収作業を行い、薬品名、規格・包装単位などの確認は当然のことながら、有効・使用期限がどの程度残っているのか、また製造番号(ロット番号)などもチェックして記録する。 ロット番号の逆転がないよう注意する(同一医薬品のロット番号が、前回の番号より小さくなった時は以前の製品より古い製品であることがわかる)。 [在庫管理〕 必要な時に必要な医薬品が、十分量在庫されていないと、保険薬局においては処方せんを持参して患者さんに大変迷惑をかけることになり、病院では、診療に大きな影響を与えることになる。最近では、多くの薬局、病院においてコンピューターを活用して在庫管理を行っている。しかし、コンピューターによる統計上の予測も利用しつつ、購入担当者の経験を加味して発注が行われる。 〔供給管理〕---病院の場合 病棟や外来診療科などに、必要な医薬品を必要量払い出す。薬剤師が入院患者さんに使用される注射薬を、各患者さん毎のカートや袋などにセットして供給する。 〔品質管理〕 医薬品は品質の確保は患者さんの安全に直接かかわるとともに、薬局への信頼にもかかわる。倉庫内における温度、光度、湿度などを適切に管理すると共に、先入れ先出し(先に購入した医薬品を先に使用する)を心掛ける。この際もロット番号の逆転がないよう注意する。 |
||||||||||||||||||||||||
| 問 232 | 医薬品情報に関する記述のうち、ただしいものの組み合わせはどれか。 | ||||||||||||||||||||||||
a 新医薬品承認審査概要は、新医薬品の承認審査過程をまとめ、開発企業が公表するものである。 b 医薬品インタビューフォームは、医療用医薬品添付文書情報の補完を目的に厚生労働省が作成する資料である。 c 教科書は信頼性が高いが速報性は低い3次情報源である。 d 医薬品安全対策情報(Drug Safety Update, DSU)は、医療用医薬品添付文書の「使用上の注意」の改訂情報を収載したものである。 |
|||||||||||||||||||||||||
| 選択肢 | 1(a、b) 2(a、d) 3(b、c) 4(b、d) 5(c、d) | ||||||||||||||||||||||||
| キッカケ | どこが発行した医薬品情報資料であるのか。どの期間の要請によるものか、その目的は何か。これらをよく把握しておこう。 |
||||||||||||||||||||||||
| 解説 | ×a 開発企業が提出した資料などを、厚生労働省が取りまとめて公表したもの。 ×b 医薬品インタビューフォームは、日本病院薬剤師会の要請によって、医薬品企業が作成した資料である。 ○c 信頼性については、教科書のレベルにもよると思うが、速報性は低い3次情報源である。 ○d DSUは、副作用調査会で審議された医療用医薬品添付文書の「使用上の注意」の改訂情報を医療関係者に早急に伝えるために日本公定書協会および日本製薬団体連合会から発行されている。 |
||||||||||||||||||||||||
| ポイント | 医薬品情報の種類 ---------------------------------- 0次情報---口頭発表による研究発表など。 1次情報---学術雑誌に掲載された論文など。(例:Lancet の原書論文) 2次情報---抄録誌、索引誌など。(例:MedLine、Chemical Abstracts) 3次情報---集大成された情報。教科書、辞書など。(例:メイラー 医薬品の副作用大事典) (だんだん情報が整理されて情報が加工されることにより、速報性はなくなっていく。) ---------------------------------- ■キーワード ◆新医薬品承認審査概要(SBA: Summary Basis of Approval) 本書は、新医薬品の効能・効果、用法・用量等薬事法に定める承認事項や、承認の根拠となった基礎及び臨床試験などのデータの概要、これらに対する評価や取り扱い、使用上の注意とその設定根拠などについて、厚生省薬務局審査課がとりまとめたものを日本公定書協会が発刊したもの。 ◆新医薬品再審査概要(SBR: Summary Basis of Re-examination) 医薬品の適正使用の推進を図るため、中央薬事審議会の評価を踏まえ再審査申請資料の基となった使用成績調査、特別調査、市販後臨床試験及び副作用報告等の市販後調査の概要がまとめられたもの。これも厚生省薬務局審査課がとりまとめたもの。 |
||||||||||||||||||||||||
| 正解 5 | |||||||||||||||||||||||||
| これで完璧!! | 厚生労働省からの医薬品資料 ---------------------------------- ○日本薬局方 ○医薬品・医療用具等安全性情報(毎月発行) ○新医薬品承認審査概要(SBA) ○新医薬品再審査概要(SBR) ---------------------------------- 製薬企業からの医薬品資料 ---------------------------------- ○医薬品添付文書 ○緊急安全性情報(厚生労働省の指示による) ○ 医薬品インタビューフォーム ○医薬品製品情報概要(製品パンフレット) ---------------------------------- その他の機関からの医薬品資料 ---------------------------------- ○DSU (日本公定書協会および日本製薬団体連合会から発行) ○医療薬日本医薬品集(日本医薬情報センター(JAPIC)から発行) ○Physicians' Desk Reference(PDR: 米国の主要な医薬品企業) --------------------------------- |