◆ 新薬情報 index
2022年8月製造販売承認
(印刷用画面へ)■エバシェルド筋注セット ■オスタバロ皮下注カートリッジ1.5mg ■乾燥細胞培養痘そうワクチンLC16「KM…
■ オスタバロ皮下注カートリッジ1.5mg
|
| 1. 承認概要 | ||
| 新有効成分 2022年8月 / 2023年1月 発売 | ||
| 2. 薬効分類名 | ||
| 骨粗鬆症治療剤 | ||
| 3. 一般的名称 | ||
| アバロパラチド酢酸塩 | ||
| 4. 適応症 | ||
| 骨折の危険性の高い骨粗鬆症 | ||
| 5. 類薬との比較 | ||
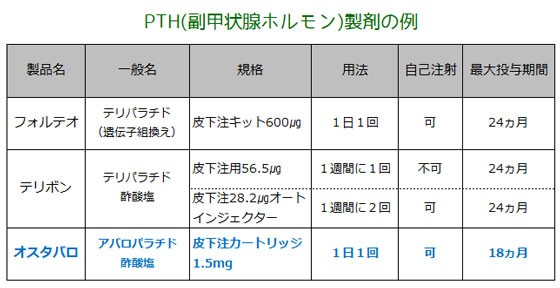 骨粗鬆症に用いるPTH製剤としては、既存薬としてテリパラチド製剤のフォルテオとテリボンがあります。 | ||
| 6. 特徴 | ||
| 【特徴】 本剤は、1日1回の皮下投与により、骨量の増加と骨折の抑制が期待されています。 【承認状況】 米国において、2017年4月に「骨折の危険性の高い閉経後骨粗鬆症」を効能又は効果として承認を取得しています(2022年3月現在)。 【作用機序】 本剤は、骨芽細胞に発現する副甲状腺ホルモン(PHT)1型受容体に結合することで、cAMPの産生などを介した骨芽細胞の増殖や分化促進による骨形成促進作用を示します。 【用法・用量】 本剤は、骨折の危険性の高い骨粗鬆症の適応で、2022年8月31日に製造販売承認を取得しました。 なお、オスタバロ皮下注3mgが2021年3月に同様の適応で製造販売承認されていますが、3mg製剤は28日投与の製剤であり、新薬の14日処方制限への対応が必要であったため現時点での薬価収載は見送られています。 【副作用】 国内および海外の第III相試験を統合した結果、臨床検査値異常を含む副作用は962例中357例(37.1%)で報告されました。主な副作用は、高カルシウム尿症81例(8.4%)、浮動性めまい55例(5.7%)、悪心52例(5.4%)、頭痛34例(3.5%)、動悸33例(3.4%)などでした。 重大な副作用として、アナフィラキシー(頻度不明)が設定されています。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 1.本剤の使用にあたっては、インジェクターのほかに製剤カートリッジ、A型専用注射針、消毒用アルコール綿が別途必要となるので、処方の確認が必要です。 【患者さんへの指導例】 1.本剤は、骨形成を促進して骨量を増やすことで、骨折を予防します。 2.投与後30分程度はできる限り安静にして、高所での作業、自動車の運転など危険が伴う作業に従事する場合は注意してください。 3.投与後に血圧低下、めまい、立ちくらみ、動悸、気分不良、悪心、顔面蒼白、冷汗などが生じた場合には、症状が治まるまで座ったり横になったりしてください。 4.悪心、嘔吐、便秘、食欲減退、腹痛などが生じた場合は受診してください。 5.(妊娠可能な女性に対して)本剤の投与期間中は避妊してください。 【ここがポイント!】 骨粗鬆症に伴う骨折は、日常生活動作やQOLの低下、生命予後の悪化につながるため、初回骨折の予防に加え、すでに骨折が生じた場合は次の骨折を予防して、骨折の連鎖を起こさないための治療が重要です。本剤はヒト副甲状腺ホルモン関連蛋白質(hPTHrP)のアミノ酸配列の一部を改変したアナログ製剤で、骨代謝に関わるPTH1型受容体のRG型を選択的に刺激するため、骨量の増加と骨折抑制が期待できます。 既存の副甲状腺ホルモン製剤(PTH製剤)としては、テリパラチド(遺伝子組換え)(商品名:フォルテオ皮下注キット)、テリパラチド酢酸塩(同:テリボン皮下注用、テリボン皮下注オートインジェクター)などが発売されています。また、抗体薬としては、抗ランクル抗体のデノスマブ(遺伝子組換え)(同:プラリア皮下注)、抗スクレロスチン抗体のロモソズマブ(遺伝子組換え)(同:イベニティ皮下注)が発売されており、超高齢社会に対応すべく効果の高い骨粗鬆症治療が近年続々と登場しています。 本剤は、海外における骨折の危険性の高い閉経後骨粗鬆患者を対象とした海外第III相試験(BA058-05-003試験、ACTIVE試験)において、プラセボに比べて投与18ヵ月の新規椎体骨折の発生率が低く、最初の非椎体骨折の発生までの期間が有意に延長されました。また、本剤投与終了後のアレンドロネートによる継続治療により、プラセボ投与終了後のアレンドロネート治療群と比較して、ACTIVE試験の開始から投与後25ヵ月および43ヵ月までの新規椎体骨折発生率が有意に低く、最初の非椎体骨発生までの期間に有意な延長が認められました(BA058-05-005試験、ACTIVE延長試験)。 本剤の電動式注入器(オスタバロインジェクター)は、製剤カートリッジを14日ごとに交換するよう設計されていて、液晶画面には操作手順、投与履歴、累計投与回数が表示されるとともに、カートリッジの交換や冷所保管忘れの通知機能なども備えられています。診察では、インジェクターに記録された投与履歴や累積回数を確認することができます。 安全面では、活性型ビタミンD製剤との併用は、血清カルシウム値が上昇する恐れがあるため避けることが望ましいとされています。本剤投与直後から数時間後にかけて、一過性の急激な血圧低下が現れることがあるので注意が必要です。また、一過性の血清カルシウム値上昇がみられることもあり、悪心、嘔吐、便秘、食欲減退、腹痛などが生じた場合は速やかに診察を受けるように患者さんに指導しましょう。
| ||
| 8. 製造販売元など | ||
| 製造販売元:帝人ファーマ株式会社 お問合せ先:帝人ファーマ株式会社 メディカル情報グループ 0120-189-315 更新情報 :未発売→2023.1発売(2023.1) 更新 2023.05.04 イラスト説明文追加 |
(文責 下平秀夫) 2022年12月/2023年5月更新