◆ 新薬情報 index
2023年4月製造販売承認
(印刷用画面へ)■メフィーゴパック
■ メフィーゴパック
|
| 1. 承認概要 | ||
| 新有効成分・新投与経路 2023年4月 / 2023年5月 発売(薬価未収載) | ||
| 2. 薬効分類名 | ||
| 人工妊娠中絶用製剤 | ||
| 3. 一般的名称 | ||
| ミフェプリストン錠・ミソプロストールバッカル錠 | ||
| 4. 適応症 | ||
| 子宮内妊娠が確認された妊娠63日(妊娠9週0日)以下の者に対する人工妊娠中絶 | ||
| 5. 類薬との比較 | ||
類薬はありません | ||
| 6. 特徴 | ||
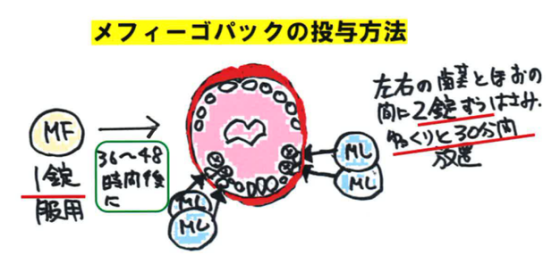
| 【特徴】 本剤は、国内で初めて承認された経口の人工妊娠中絶薬であり、中絶を望む女性にとって身体的にも精神的にも負担が少ない薬剤と考えられます。 【承認状況】 妊娠63日以下の者に対する人工妊娠中絶の適応で2014年6月に豪州で承認されて以降、2022年9月現在、2ヵ国(豪州及び加国)で承認されています。 【作用機序】 ミフェプリストンはプロゲステロン受容体拮抗薬であり、プロゲステロンによる妊娠の維持を阻害する作用および子宮頸管熟化作用を有します。ミソプロストールはプロスタグランジンE1誘導体であり、子宮頸管熟化作用や子宮収縮作用を有します。両剤の作用により妊娠の継続を中断し、胎嚢を排出します。 【用法・用量】 ミフェプリストン錠1錠(ミフェプリストンとして200mg)を経口投与し、その36~48時間後の状態に応じて、ミソプロストールバッカル錠4錠(ミソプロストールとして計800μg)を左右の臼歯の歯茎と頬の間に2錠ずつ30分間静置します。30分後も口腔内に錠剤が残っている場合は飲み込みます。 ミフェプリストン投与後に胎嚢の排出が認められた場合、子宮内容物の遺残の状況を踏まえてミソプロストールの投与の要否を検討します。 【副作用】 国内第III相試験において1%以上に認められた副作用は、下腹部痛、悪心、嘔吐、下痢、発熱、悪寒でした。 重大な副作用として、重度の子宮出血(0.8%)のほか、感染症、重度の皮膚障害、ショック、アナフィラキシー、脳梗塞、心筋梗塞、狭心症(いずれも頻度不明)が設定されています。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 1.併用禁忌の薬剤として、子宮出血の程度が悪化する恐れがあるため、抗凝固薬(ワルファリンカリウム、DOAC)や抗血小板薬(アスピリン、クロピドグレル硫酸塩、EPA製剤など)があります。また、ミフェプリストンの血漿中濃度が低下し、効果が減弱する恐れがあるため、中~強程度のCYP3A誘導剤(リファンピシン、リファブチン、カルバマゼピン、セイヨウオトギリソウ含有食品など)も併用禁忌となっています。 【患者さんへの指導例】 1.本剤は、妊娠9週以下の人に対する人工妊娠中絶の薬です。妊娠の継続に必要な黄体ホルモンの働きを抑える薬剤と、子宮収縮作用により子宮内容物を排出させる薬剤を組み合わせたパック製剤です。 2.この薬の投与後は下腹部痛や子宮出血が現れて一定期間継続します。まれに重度の子宮出血が生じて貧血が悪化することがあるため、自動車の運転などの危険を伴う機械操作を行う場合は十分に注意してください。 3.服用後、2時間以上にわたって夜用ナプキンを1時間に2回以上交換しなければならないような出血が生じた場合、発熱、寒気、体のだるさ、腟から異常な分泌物などが生じたときは速やかに医師に連絡してください。 4.授乳中に移行することが知られているので、授乳をしている場合は事前にお伝えください。 5.子宮内避妊用具(IUD)またはレボノルゲストレル放出子宮内システム(IUS)を使用中の人はこの薬の投与を受ける前に除去する必要があります。 【ここがポイント!】 本剤は、国内で初めて承認された人工妊娠中絶のための経口薬です。これまで妊娠初期の中絶は掻把法や吸引法によって行われてきましたが、今回新たに経口薬が選択肢に加わりました。ミフェプリストンとミソプロストールの順次投与による中絶法は、世界保健機関(WHO)が作成した「安全な中絶−医療保険システムにおける技術及び政策の手引き−」で推奨されており、海外では広く使用されています。 使用方法は、1剤目としてミフェプリストン錠1錠を経口投与し、その36~48時間後にミソプロストール錠4錠をバッカル投与します。国内第III相試験では、投与後24時間以内の人工妊娠中絶が成功した患者の割合は93.3%で、安全性プロファイルは認容できるものでした。 本剤投与後に、失神などの症状を伴う重度の子宮出血が認められることがあり、外科的処置や輸血が必要となる場合があります。また、重篤な子宮内膜炎が発現することがあり、海外では敗血症や中毒性ショック症候群に至り死亡した症例が報告されていることから、異常が認められた場合に連絡を常に受けることができる体制や、ほかの医療機関との連携も含めた緊急時に適切な対応が取れる体制で本剤を投与することが求められています。 本剤の承認申請が行われた2021年12月以降、社会的に大きな関心を集めました。厚生労働省が承認にあたってパブリックコメントを実施したところ1万1,450件もの意見が寄せられ、そのうち承認を支持する意見が68.3%、不支持が31.2%でした。欧米では経口薬による人工妊娠中絶法は30年以上前から行われていて、先進国を中心に主流になりつつあります。 中絶を望む女性は、健康上の懸念がある、性的暴力を受けた、若すぎる、経済的に困窮している、パートナーの協力を得られないなどさまざまな背景があります。わが国では現在、薬局やインターネットで購入することはできませんが、多くの議論を経て、中絶を望む人たちにとって、医学的にも精神的にも寄り添うことのできるシステムが構築されることが望まれます。 《OTC化に向けた取り組み》 日本薬剤師会により、緊急避妊薬のOTC化に向けた試験的運用が2023年11月28日から開始されました。 16歳以上の女性が対象です。薬剤師は下記を熟読し、販売について問い合わせがあったら、こちらのサイトをまず確認するように説明してください。 緊急避妊薬試験販売について 一部薬局での販売は、国(厚生労働省)からの委託を受けた調査研究として行われています。 購入を希望される方は、研究への参加同意や機微な情報も含む質問やアンケート等への協力できる場合にのみ販売が可能となります。 なお、現在、日本で緊急避妊薬を入手する方法は、医療機関(産婦人科など)への受診による方法によります。この調査研究に薬局・購入者が参加する場合のみ、医療機関の受診を経ない、薬局での販売が認められています。 | ||
| 8. 製造販売元など | ||
| 製造販売元:ラインファーマ株式会社 お問合せ先:ラインファーマ株式会社 03-4510-4033 |
(文責 下平秀夫) 2023年11月