◆ 新薬情報 index
2023年6月製造販売承認
(印刷用画面へ)■リトゴビ錠4mg ■コレチメント錠9mg ■リットフーロカプセル50mg ■パルモディアXR錠0.2mg,同0.4m…
■ リトゴビ錠4mg
|
| 1. 承認概要 | ||
| 新有効成分 2023年6月 / 2023年9月 発売 | ||
| 2. 薬効分類名 | ||
| 抗悪性腫瘍剤/FGFR阻害薬 | ||
| 3. 一般的名称 | ||
| フチバチニブ | ||
| 4. 適応症 | ||
| がん化学療法後に増悪した FGFR2 融合遺伝子陽性の治癒切除不能な胆道癌 | ||
| 5. 類薬との比較 | ||
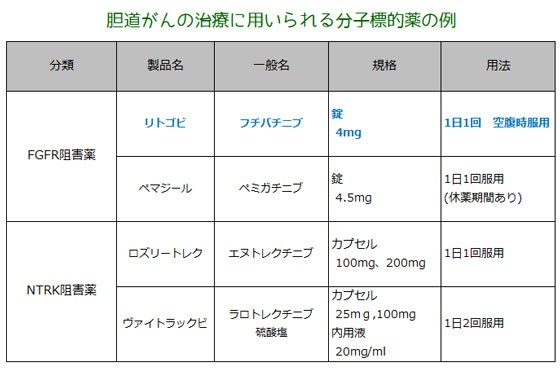 <類薬> 胆道がんに対する分子標的薬としては、本剤のようなFGFR阻害薬とNTRK阻害薬が使用されています。 既存のFGFR阻害薬としては、がん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道がんを適応とするペミガチニブ(ペマジール錠)が2021年3月に承認されています。 | ||
| 6. 特徴 | ||
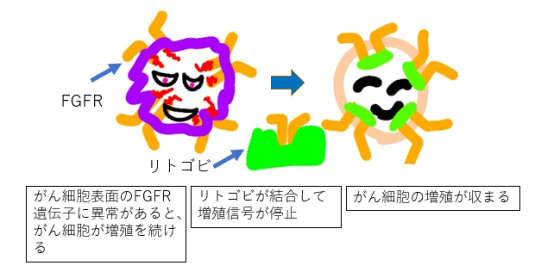
| 【特徴】 本剤は、FGFR1~4遺伝子異常を持つ腫瘍細胞の増殖を抑制して細胞死を誘導する経口の抗がん剤であり、胆道がん患者さんの二次治療以降に用います。 【承認状況】 海外では、米国で「前治療歴を有するFGFR2融合遺伝子またはその他の再構成を伴う切除不能な局所進行または転移性肝内胆管がん」の適応で2022年9月に承認されています(2023年6月現在)。 【作用機序】 本剤は、FGFR1~4の4種類すべてを選択的かつ不可逆的に阻害することで、FGFR遺伝子増幅、変異、融合または再構成などの異常を有するがん細胞において細胞内シグナル伝達を抑制し、抗悪性腫瘍効果を示すと考えられています。 【用法・用量】 通常、FGFR2融合遺伝子が確認された成人には、フチバチニブとして1日1回20mgを空腹時に経口投与します。食後に本剤を投与した場合、本剤のCmaxおよびAUCが低下するという報告があるため、食事の1時間前から食後2時間までの間の服用は避けます。 本剤投与により副作用が発現した場合には、通常投与量20mg→1段階減量16mg→2段階減量12mg→投与中止という基準を参考に減量・中止します。 【副作用】 国際共同第I/II相試験(TAS-120-101試験)第II相パートおいて多く認められた副作用は、高リン血症(85.4%)、脱毛症33.0%、口内乾燥30.1%、下痢28.2%、皮膚乾燥27.2%、口内炎20.4%、疲労25.2%、手掌・足底発赤知覚不全症候群21.4%、味覚異常18.4%、爪の障害15.5%などでした。 なお、重大な副作用として、網膜剥離(漿液性網膜剥離[1.0%]、網膜色素上皮剥離[1.0%])など)、高リン血症(91.3%)が報告されています。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 1.本剤は一次治療としては用いられません。 2.本剤を食後に投与すると、CmaxおよびAUCが低下するので、食事の1時間前から食後2時間までの間の服用は避けます。 3.FGFR阻害薬による高リン血症は高頻度で起こるので、インスタント食品やファストフード、清涼飲料水などのリンを多く含有する食品をなるべく控えることも指導しましょう。 【患者さんへの指導例】 1.この薬は、FGFR2遺伝子に異常がある胆道がんの治療薬で、ほかの抗がん剤による治療で効果が不十分になったとき(二次治療以降)に使用されます。 3. 高リン血症が現れることがあるので、定期的に血液検査で血清リン濃度を測定します。 4.網膜障害が起きることがあるので、視力が下がる、視野が狭くなる、飛蚊症など眼の異常を感じたら、速やかにご相談ください。 5.妊娠する可能性のある女性は、この薬を使用している間および使用終了後1週間は適切な避妊をしてください。男性もこの薬を使用している間および使用終了後1週間は、バリア法(コンドーム)で避妊してください。 【ここがポイント!】 <胆道がんの治療> 胆道がんの治療の基本は外科手術です。切除不能な胆道がんの主な治療法は薬物療法となります。切除不能例で初めて受ける治療である一次治療としては、ゲムシタビン、シスプラチン(CG療法)、TS1(ティーエスワン)が組み合わせて用いられます。 <切除不能例の二次治療、三次治療> その次に受ける治療の二次治療以降の治療として、上記のような細胞障害性抗がん剤の他に、分子標的薬や免疫チェックポイント阻害薬が使用されます。分子標的薬として本剤のようなFGFR阻害薬とNTRK阻害薬が使用されます。 胆道がんのうち、とくに胆管がんは予後不良で治療選択肢も限られており、がんの発生や進行に直接的な役割を果たす遺伝子ドライバー遺伝子であるFGFR2融合遺伝子を標的にする治療が選択肢にあげられます。 <臨床成績> 全身療法の治療歴のある局所進行または転移性の切除不能な肝内胆管がん患者を対象とした多施設オープンラベル単群試験TAS-120-101試験(FOENIX-CCA2試験)で、主要評価項目である奏効率は42%(95%信頼区間:32~52)で、奏効期間中央値は9.7ヵ月(同:7.6~17.1)、無増悪生存期間中央値は9ヵ月、全生存期間中央値は21.7ヵ月でした。 | ||
| 8. 製造販売元など | ||
| 製造販売元:大鵬薬品工業株式会社 お問合せ先:大鵬薬品工業株式会社 医薬品情報課 0120-20-4527 |
(文責 下平秀夫) 2023年11月