◆ 新薬情報 index
2020年1月製造販売承認
(印刷用画面へ)■ユリス錠0.5mg,1mg,2mg ■リンヴォック錠7.5mg,15mg ■デエビゴ錠2.5mg,5mg,10mg ■コレクチム軟膏0.5%
■ リンヴォック錠7.5mg,15mg
|
| 1. 承認概要 | ||
| 新有効成分 2020年1月 / 2020年4月 発売 | ||
| 2. 薬効分類名 | ||
| ヤヌスキナーゼ(JAK)阻害剤 | ||
| 3. 一般的名称 | ||
| ウパダシチニブ水和物 | ||
| 4. 適応症 | ||
| <関節リウマチ> 2020年 1 月「既存治療で効果不十分な関節リウマチ(関節の構造的損傷の防止を含む)」の適応取得。 <乾癬性関節炎> 2021 年 5 月に「既存治療で効果不十分な乾癬性関節炎」の適応を追加。 2022 年 5 月に「既存治療で効果不十分な強直性脊椎炎」の適応を追加。 <アトピー性皮膚炎> 2021 年 8 月に「既存治療で効果不十分なアトピー性皮膚炎」の適応を追加。2024 年 9 月に12 歳以上かつ体重 30 kg 以上の小児に対して 30 mg の投与が可能となった. <潰瘍性大腸炎> 2022 年 9 月に「中等症から重症の潰瘍性大腸炎の寛解導入及び維持療法(既存治療 で効果不十分な場合に限る)」の適応を追加。 <クローン病> 2023 年 6 月に「中等症から重症の活動期クローン病の寛解導入及び維持療法(既存治療で効果不十分な場合に限る)」の適応を追加。 | ||
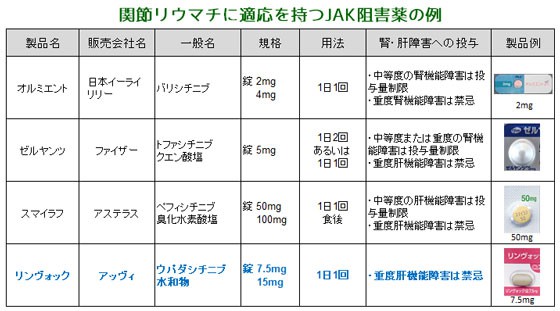
| 5. 類薬との比較 | ||
 ■「アトピー性皮膚炎」の適応について、2024年10月に「新しいアトピー性皮膚炎治療薬の例」を表にまとめましたのでご参照ください。 ⇒サイバインコ錠50mg,100mg,200mg | ||
| 6. 特徴 | ||
| 【特徴】 本剤は、関節リウマチに適応をもつ4番目のヤヌスキナーゼ(JAK)阻害薬であり、特にJAK1に選択的に働くという特徴があります。中等度から重度の関節リウマチ患者において、メトトレキサート(MTX)などとの併用の有無にかかわらず、1日1回の投与で臨床的寛解を達成することが期待されています。 【承認状況】 海外では、2019年8月に米国で承認されました。 【作用機序】 本剤は、JAKの4種類、JAK1、JAK2、JAK3、TYK2のうち、JAK1を選択的に阻害しインターロイキン(IL)やインターフェロン(IFN)といった炎症性サイトカインの異常な産生を抑えます。 【用法・用量】 <関節リウマチ> 通常、成人にはウパダシチニブとして15mgを1日1回経口投与します。なお、患者の状態に応じて7.5mgを1日1回投与することもできます。 免疫抑制作用の増強により感染症リスクの増加が予想されるので、本剤とほかのJAK阻害薬や生物学的製剤、タクロリムス、シクロスポリン、アザチオプリン、ミゾリビンなどの免疫抑制薬(局所製剤以外)との併用はできません。 【副作用】 関節リウマチ患者を対象とした本剤のプラセボ対照第III相試験において、本剤が投与された1,035例中275例(26.6%)に臨床検査値異常を含む副作用が認められました。主な副作用は、悪心23例(2.2%)、上気道感染、頭痛、アラニンアミノトランスフェラーゼ増加各19例(1.8%)、血中クレアチンホスホキナーゼ増加17例(1.6%)、気管支炎16例(1.5%)などでした(承認時)。 なお、重大な副作用として、肺炎(0.1%未満)、帯状疱疹(0.7%)、結核(頻度不明)などの重篤な感染症(日和見感染症を含む)、消化管穿孔(頻度不明)、好中球減少(1.4%)、リンパ球減少(0.8%)、ヘモグロビン減少(貧血:0.7%)、ALT上昇(1.8%)、AST上昇(1.4%)、間質性肺炎(頻度不明)および静脈血栓塞栓症(頻度不明)が報告されています。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 1.敗血症等の重篤な感染症の患者や活動性結核の患者には、症状を悪化させるおそれがあるため、禁忌です。 2.重度の肝機能障害を有する患者には、副作用が強くあらわれるおそれがあるため、禁忌です。 【患者さんへの指導例】 1.この薬はJAKという酵素を強く阻害することで、関節リウマチなどの症状を改善します。 2.薬の成分が少しずつ出るようにコーティングされているので、かみ砕かないでください。 3.本剤の服用を長期間続けると、免疫力が低下する可能性があります。持続する発熱やのどの痛み、息切れ、咳、倦怠感、水疱、痛みを伴う皮疹などが現れた場合は、すぐにご連絡ください。 4.この薬を服用している間は、生ワクチン(麻疹、風疹、おたふく風邪、水痘・帯状疱疹、BCGなど)の接種ができません。接種の必要がある場合は主治医に相談してください。 5.(妊娠可能年齢の女性の場合)この薬を服用中および最終服用後一定の期間は、適切な避妊を行ってください。なお、国内治験においては、最終投与から30日まで避妊を行うよう定められていました。 【ここがポイント!】 関節リウマチの薬物療法は近年大きく進展しています。通常、発症初期はMTXをはじめとする従来型合成疾患修飾性抗リウマチ薬(csDMARD)が使用されますが、十分量用いても効果が不十分な場合には、生物学的製剤、もしくは本剤のようなJAK阻害薬が選択されます。 本剤は、関節リウマチに適応を持つ4番目のJAK阻害薬です。JAKには4種類のサブタイプ(JAK1、JAK2、JAK3、Tyk2)があり、本剤は炎症性サイトカインシグナルの伝達においてとくに重要な役割を持つJAK1を強く阻害することで、TNFαやIL-6の働きを遮断し、炎症性サイトカインの産生を抑制すると考えられています。 本剤は、MTXで効果不十分な関節リウマチ患者を対象とした第III相無作為化二重盲検比較試験で、12週時のACR50改善率、患者による疼痛評価およびHAQ-DIのベースラインからの変化量において、ヒト型抗ヒトTNFαモノクローナル抗体製剤アダリムマブ(商品名:ヒュミラ)に対する優越性が示されました。また、ウパダシチニブ+MTX群では、プラセボ+MTX群およびアダリムマブ+MTX群と比較して、有意に高い臨床的寛解達成率が示されました。 安全性に関する留意事項としては、警告欄で結核、肺炎などの重篤な感染症について注意喚起されています。また、トファシチニブ(同:ゼルヤンツ)、ペフィシチニブ(同:スマイラフ)と同様に、重度の肝機能障害患者には禁忌となっています。 本剤は徐放性フィルムコーティング錠であり、調剤時に半割・粉砕することはできません。患者に対しても、割ったりかみ砕いたりしないように伝えましょう。 | ||
| 8. 製造販売元など | ||
| 製造販売元:アッヴィ合同会社 お問合せ先:アッヴィ合同会社 くすり相談室 0120-587-874 更新:2024/10/09 剤型追加 について リンヴォック錠30mg、同40mgは、2021年9月に承認 更新:2024/10/09 適応症追加 について <乾癬性関節炎> 2021 年 5 月に「既存治療で効果不十分な乾癬性関節炎」の適応を追加。 <アトピー性皮膚炎注> 2021 年 8 月に「既存治療で効果不十分なアトピー性皮膚炎」の適応を追加。2024 年 9 月に12 歳以上かつ体重 30 kg 以上の小児に対して 30 mg の投与が可能となった. <潰瘍性大腸炎> 2022 年 9 月に「中等症から重症の潰瘍性大腸炎の寛解導入及び維持療法(既存治療 で効果不十分な場合に限る)」の適応を追加。 <クローン病> 2023 年 6 月に「中等症から重症の活動期クローン病の寛解導入及び維持療法(既存治療で効果不十分な場合に限る)」の適応を追加。 |
(文責 下平秀夫) 2020年6月/2024年10月更新