◆ 新薬情報 index
2021年9月製造販売承認
(印刷用画面へ)■サイバインコ錠50mg,100mg,20… ■エフメノカプセル100mg ■モイゼルト軟膏0.3%、1% ■ゼビュディ点滴静注液500mg
■ モイゼルト軟膏0.3%、1%
|
| 1. 承認概要 | ||
| 新有効成分 2021年9月 / 2022年6月 発売 | ||
| 2. 薬効分類名 | ||
| アトピー性皮膚炎治療剤 | ||
| 3. 一般的名称 | ||
| ジファミラスト | ||
| 4. 適応症 | ||
| アトピー性皮膚炎 | ||
| 5. 類薬との比較 | ||
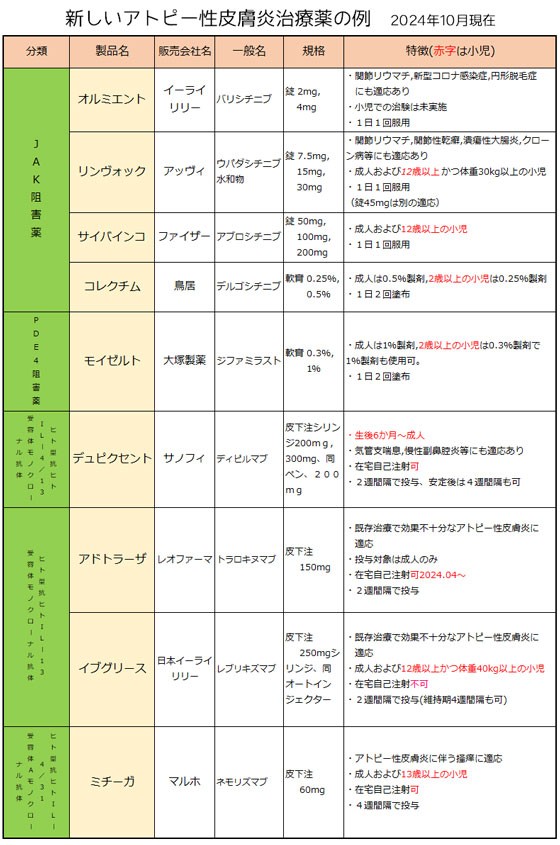 新しいアトピー性皮膚炎治療薬を追加しました(2024.10) | ||
| 6. 特徴 | ||
| 【特徴】 本剤は、ホスホジエステラーゼ4(PDE4)阻害作用を有する外用のアトピー性皮膚炎治療薬であり、既存薬とは異なる作用機序で皮膚の炎症を抑制します。 【2歳以上の小児から「生後3ヶ月以上」に対象が拡大】2023.12 これまでは2歳以上の小児に限られていましたが、生後3箇月以上2歳未満の乳幼児アトピー性皮膚炎患者を対象とした国内臨床試験を実施し、有効性と安全性が確認されたことから、2023年12月に「生後3か月以上」の小児に対しても使用可能となりました。 【承認状況】 海外で製造販売が承認されている国・地域はありません(2021年9月現在)。 【作用機序】 アトピー性皮膚炎などの病態に関与するとされるPDE4は多くの免疫細胞に存在し、cAMPを特異的に分解する働きを持ちます。本剤は、PDE4の活性を阻害し炎症細胞内のcAMP濃度を高めることで、炎症性サイトカインの放出抑制と抗炎症サイトカインの放出促進により皮膚症状を緩和します。 【用法・用量】 通常、成人には1%製剤を1日2回、小児には0.3%製剤を1日2回、適量を患部に塗布します。小児でも、症状に応じて1%製剤を使用することができますが、症状が改善した場合は0.3%製剤への変更を検討します。 なお、1%製剤で治療開始4週間以内に症状の改善が認められない場合は、使用を中止します。 【副作用】 国内でアトピー性皮膚炎患者を対象に行われた第III相試験では、本剤1%を投与した15歳以上182例中1例(0.5%)、2~14歳85例中3例(3.5%)、同様に本剤0.3%を投与した2~14歳83例中5例(6.0%)で副作用が報告されました。 また、長期投与試験では本剤1%を投与した15歳以上166例中14例(8.4%)、2~14歳56例中8例(14.3%)、同様に本剤0.3%を投与した2~14歳144例中8例(5.6%)で副作用が報告されました。 主な副作用は、色素沈着障害、毛包炎、掻痒症、ざ瘡などでした。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 1.低出生体重児、新生児、生後3か月未満の乳児を対象とした臨床試験は行われていません。 2.妊婦への使用については、ラットにおいて大量に使用した場合に胎児死亡率などが高くなったことが報告されており、投与しないことが望ましいとされています。 3.授乳婦については、ラットにおいて授乳中の移行が報告されているので有益性投与です。 【患者さんへの指導例】 1.この薬は、体内の炎症物質の活性を阻害することで、皮膚の炎症を抑えてアトピー性皮膚炎の症状を改善します。 2.通常、人差し指の指先から第一関節まで(約2.5cm)チューブから押し出した量が、成人の手のひら2枚分の広さを塗るために必要な量です。 3.粘膜や傷がある部位には塗らないでください。 4.(女性に対して)この薬を使用している間および使用終了から一定期間は確実な方法で避妊してください。 | ||
| 8. 製造販売元など | ||
| 製造販売元:大塚製薬株式会社 お問合せ先:大塚製薬株式会社 医薬情報センター 0120-189-840 更新情報(2023.2) :未発売→2022.6発売 更新情報(2023.12) :適用が2歳以上→生後3か月以上 更新情報(2024.10) 類薬の表を更新 |
(文責 下平秀夫) 2022年3月/2024年10月更新