◆ 新薬情報 index
2023年3月製造販売承認
(印刷用画面へ)■フルミスト点鼻液 ■ゴービック水性懸濁注シリンジ ■エムパベリ皮下注1080mg ■アポハイドローション20% ■リネイルゲル10% ■ウゴービ皮下注0.25mg,0.5mg,…
■ ウゴービ皮下注0.25mg,0.5mg,1.0mg,1.7mg,2.4mg SD
|
| 1. 承認概要 | ||
| 新効能・新剤型・新用量 2023年3月 / 2024年2月 発売 | ||
| 2. 薬効分類名 | ||
| 肥満症治療剤 持続型 GLP-1 受容体作動薬 | ||
| 3. 一般的名称 | ||
| セマグルチド(遺伝子組換え) | ||
| 4. 適応症 | ||
| 肥満症 ただし、高血圧、脂質異常症又は 2 型糖尿病のいずれかを有し、食事療法・運動療法を行っても十分な効果が得られず、以下に該当する場合に限る。 ・BMI が 27kg/㎡ 以上であり、2 つ以上の肥満に関連する健康障害を有する ・BMI が 35kg/㎡以上 | ||
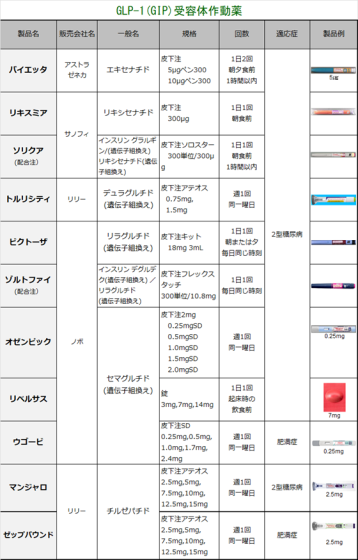
| 5. 類薬との比較 | ||
 本剤は、2023年11月22日に薬価収載され2024年2月22日に発売されました。 【添付文書】 添付文書はこちら。 日本肥満学会はウゴービ皮下注について単なる肥満に投与するような不適正使用を慎むように「肥満症治療薬の安全・適正使用に関するステートメント」を策定しました。2023.11.25 | ||
| 6. 特徴 | ||
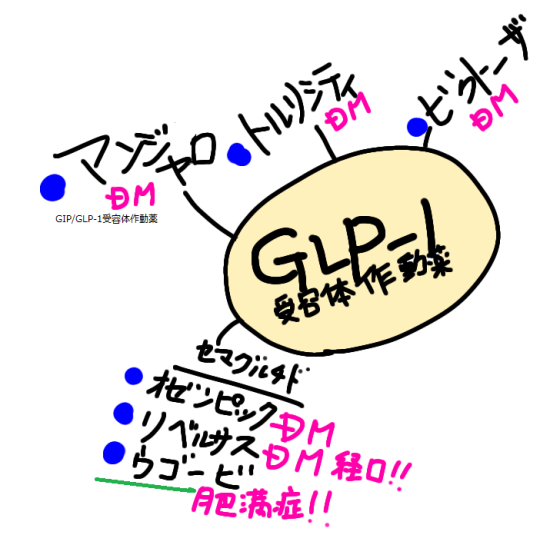
| 【特徴】 本剤は肥満症を適応として承認された日本で初めてのGLP-1受容体作動薬です。糖尿病治療薬のオゼンピック皮下注、リベルサス錠と同成分です。高血圧などを有し、食事・運動療法を行っても十分な効果が得られない肥満症患者の体重減少効果が期待されています。 【承認状況】 海外においては、「体重管理」を効能又は効果として2021年6月4日に米国で、2022年1月6日に欧州にてそれぞれ承認されています(販売名:Wegovy)。 また、わが国においては、同一有効成分の製剤として、週1回投与の注射剤であるオゼンピック®皮下注2mg(承認日:2018年3月23日)、オゼンピック®皮下注0.25mg SD、同注0.5mg SD及び同注1.0mg SD(承認日:2020年3月12日)及び1日1回投与の経口剤であるリベルサス®錠3mg、同錠7mg及び同錠14mg(承認日:2020年6月29日)がそれぞれ「2型糖尿病」を効能又は効果として承認されています(2023年3月現在)。 2024.03のトピックスとして、FDAが心血管疾患に適応拡大承認しました。糖尿病ではない肥満の成人について脳脳卒中と心臓発作リスクを下げるというものです。 【作用機序】 GLP-1受容体を介して脳の食欲調節機構に対して作用することなどにより、肥満症患者に対する体重減少効果を発揮するGLP-1受容体作動薬です。また、アルブミンと結合して代謝による分解の遅延および腎クリアランスの低下を示すと考えられており、さらに、アミノ酸置換によりジぺプチジルペプチターゼ(DPP)-4による分解に対して抵抗性を示すことで作用が持続します。 【用法・用量】 通常、成人には、セマグルチドとして0.25mgから投与を開始し、週1回皮下注射します。その後は4週間の間隔で、週1回0.5mg、1.0mg、1.7mg、2.4mgの順に増量し、以降は2.4mgを週1回皮下注射します。患者さんの状態に応じて適宜減量します。 【副作用】 日本人被験者が参加した第III相試験(NN9536-4373試験、NN9536-4374試験、NN9536-4382試験)において、2,008例中1,359例(67.7%)に副作用が発現しました。主なものは、悪心(36.4%)、下痢(23.5%)、嘔吐(19.1%)、便秘(19.0%)などでした。 なお、重大な副作用として、低血糖、急性膵炎(0.1%)、胆嚢炎、胆管炎、胆汁うっ滞性黄疸が設定されています(発現率の記載のないものは頻度不明)。
| ||
| 7. 使用上の注意と服薬支援 | ||
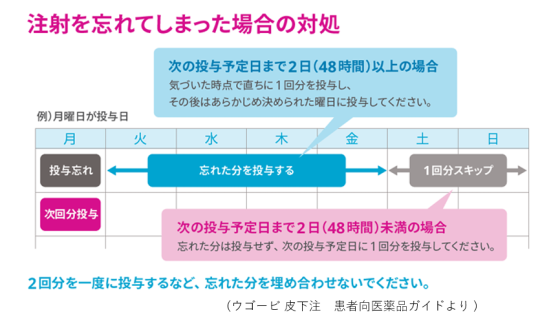
| 【薬剤師への注意】 1.重大な副作用として、低血糖、急性膵炎が現れることがあります。嘔吐を伴う持続的な激しい腹痛などが現れた場合は急性膵炎の可能性を考慮し、使用を中止して速やかに医師の診察を受けるように指導しましょう。 【患者さんへの指導例】 1.この薬には、脳に作用して食欲を抑えることで、体重を減らす作用があります。 2.血糖値を下げる作用があるため、脱力感、倦怠感、高度の空腹感、めまいなどの低血糖症状が現れた場合は糖質を含む食品を取ってください。また、高所作業、自動車の運転などに注意してください。 3.1週間に1回、同一曜日に皮下に注射してください。適切な在宅自己注射教育を受けた患者さんまたはご家族は自己注射することができます。注射は、腹部、ふともも、上腕に行います。注射箇所は毎回変更し、少なくとも前回の場所から2~3cm離して注射してください。 4.1回使い切りの注射薬です。 5.嘔吐を伴う持続的な激しい腹痛などの症状が現れた場合は、使用を中止して速やかに医師の診察を受けてください。 6.次回の投与日を忘れないように、カレンダーなどに書き留めることをお勧めします。 7.凍結を避けて冷蔵庫(2~8℃)で保管してください。 【ここがポイント!】 本剤は、肥満症治療薬として承認された唯一のGLP-1受容体作動薬です。固定注射針付きシリンジを注入器にセットした単回使用のコンビネーション製品で、週1回皮下投与します。名称の「SD」は、単回投与を意味するSingle Doseの頭文字に由来します。 GLP-1は小腸のL細胞から分泌されるインクレチンホルモンであり、血糖降下作用のほか、中枢における摂食抑制作用を有するため、体重を減少させる効果があります。本剤とDPP-4阻害薬はいずれもGLP-1受容体を介した血糖降下作用を有しているため、2型糖尿病を有する患者において両剤が併用された際の有効性および安全性は確認されていません。 投与する対象患者については厳しい条件が課せられていて、(1)高血圧、脂質異常症または2型糖尿病のいずれかを有していること、(2)食事療法・運動療法を行っても効果が不十分であること、(3-1)BMIが27kg/m2以上かつ2つ以上の肥満に関連する健康障害を有していること、または(3-2)BMIが35kg/m2以上であることが求められます。 日本人が参加した国際共同第III相試験(NN9536-4373試験、NN9536-4374試験)および国際共同第III相試験(NN9536-4382試験)において、投与68週時までの体重変化率および5%以上の体重減少達成率でプラセボに対する優越性を示しました。 なお、ウゴービは発売されてから約1年間は2週間分の薬剤しか処方できません。 本剤と同じセマグルチドを有効成分とする薬剤として、週1回投与の注射剤であるオゼンピック皮下注が2018年3月に、1回使い切りの同SD製剤が2020年3月に、1日1回投与の経口薬であるリベルサス錠が2020年6月に、それぞれ2型糖尿病を効能・効果として承認されています。 自由診療において、これらの薬剤がダイエット・美容目的で適応外処方されることが問題となっています。ウゴービ皮下注の臨床試験では、BMIならびに肥満に関連する健康障害の参加基準が厳格に定められていたことから、これらの薬剤の不適正使用について日本糖尿病学会から注意喚起されており、健康被害の防止と適正使用の推進が求められています。 本剤は健康障害を伴わない(したがって肥満症とは診断されない)肥満は適応外です。また普通体重など適応外の体重者に対し美容・痩身・ダイエット等の目的で用いることのないように、十分留意すべきです。
| ||
| 8. 製造販売元など | ||
| 製造販売元:ノボ ノルディスク ファーマ株式会社 お問合せ先:ノボ ノルディスク ファーマ株式会社 ノボケア相談室 0120-180363 更新 2023-11-23 発売予定日を記載 更新 2023-11-30 日本肥満学会のステートメントリンクを記載 更新 2024-02-29 本剤が発売されたことを記載 更新 2024-03-14 添付文書リンク等記載、FDA適応改題を記載 |
(文責 下平秀夫) 2023年6月/2024年7月更新