◆ 新薬情報 index
2022年9月製造販売承認
(印刷用画面へ)■メトジェクト皮下注7.5mgシリンジ0.… ■グラアルファ配合点眼液 ■ソーティクツ錠6mg ■マンジャロ皮下注2.5mg,5mg,7.…
■ メトジェクト皮下注7.5mgシリンジ0.15mL,同10mgシリンジ0.20mL,同12.5mgシリンジ0.25mL,同15mgシリンジ0.30mL
|
| 1. 承認概要 | ||
| 新効能・新剤型・新用量 2022年9月 / 2022年11月 発売 | ||
| 2. 薬効分類名 | ||
| 抗リウマチ剤 | ||
| 3. 一般的名称 | ||
| メトトレキサート | ||
| 4. 適応症 | ||
| 関節リウマチ ■添付文書 ■患者向医薬品ガイド | ||
| 5. 類薬との比較 | ||
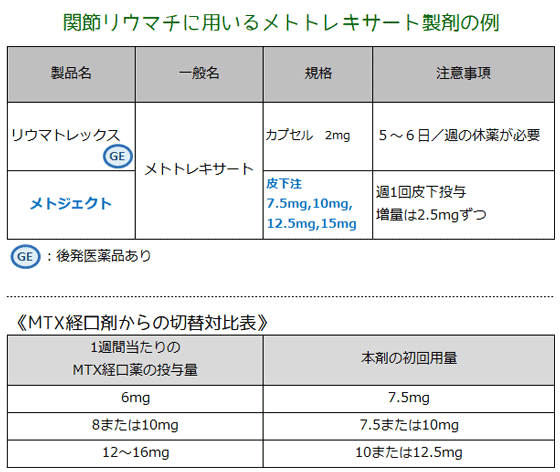 リウマトレックスは経口で、連日服用などの事故が発生。メトジェクトは医師の皮下注への投与なので事故の危険が少ない。 | ||
| 6. 特徴 | ||
| 【特徴】 本剤は、国内初の自己注射可能なメトトレキサート(MTX)皮下注製剤であり、関節リウマチ(RA)患者の服薬アドヒアランスの向上に加え、誤投与・過剰投与リスクの軽減が期待されています。 【承認状況】 本剤は欧州を中心とした49の国又は地域で承認されています(2022 年 9 月現在)。 【作用機序】 葉酸を核酸合成に必要な活性型葉酸に還元させるジヒドロ葉酸還元酵素(DHFR)の働きを阻止し、チミジル酸合成およびプリン合成系を阻害して、抗免疫・抗炎症作用を発揮します。 【用法・用量】 通常、成人にはMTXとして7.5mgを週に1回皮下注射します。患者の状態や忍容性などに応じて適宜増量できますが、15mgを超えることはできません。4週を目安に患者の状態を十分に確認し、増量は2.5mgずつ行います。 【副作用】 国内第III相臨床試験(MC-MTX.17/RA試験)において、83.8%(93/111例)に臨床検査値異常を含む有害事象が認められました。5%以上に認められたものは、悪心16.2%、口内炎14.4%、関節リウマチ11.7%、上咽頭炎10.8%、ALT増加9.9%、肝機能異常9.9%、白血球数減少8.1%、上腹部痛5.4%、高血圧5.4%などでした。 なお、重大な副作用として、ショック/アナフィラキシー(頻度不明)、骨髄抑制(5%以上)、感染症(0.1~5%未満)、結核、劇症肝炎/肝不全、急性腎障害/尿細管壊死/重症ネフロパチー、間質性肺炎/肺線維症/胸水、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)/皮膚粘膜眼症候群(Stevens-Johnson症候群)、出血性腸炎/壊死性腸炎、膵炎、骨粗鬆症、脳症(白質脳症を含む)、進行性多巣性白質脳症(PML)(いずれも頻度不明)が設定されています。
| ||
| 7. 使用上の注意と服薬支援 | ||
| 【薬剤師への注意】 1.骨髄抑制のある患者には、骨髄抑制を増悪させるおそれがあるため禁忌です。 2.慢性肝疾患のある患者、 腎障害のある患者には、副作用が強くあらわれるおそれがあるため禁忌です。 【患者さんへの指導例】 1.この薬は、異常な状態となっている免疫反応や炎症反応を抑えることで、関節リウマチによる関節の腫れや痛みを改善します。 2.通常、週に1回、特定の曜日に皮下注射してください。 3.注射部位は大腿部・腹部・上腕部の毎回異なる部位を選び、短期間に同一部位へ繰り返して投与しないでください。 4.この薬を投与している間は、生ワクチン(麻疹、風疹、おたふく風邪、水痘・帯状疱疹、BCGなど)の接種ができません。接種の必要がある場合は医師に相談してください。 5.発熱、倦怠感が現れた場合や、口内炎、激しい腹痛、嘔吐、下痢などの症状が現れた場合は直ちに医師に連絡してください。 6.(妊娠可能年齢の女性やパートナーが妊娠する可能性のある男性に対して)この薬を投与中および投与終了後一定の期間は、適切な方法で避妊を行ってください。 7.(授乳中の女性に対して)薬剤が乳汁中へ移行する可能性があるため、本剤の投与中は授乳しないでください。 【ここがポイント!】 関節リウマチ(RA)治療の基本は、疾患活動性を低く抑え、早期の臨床的寛解を達成・維持することです。MTXはRAの病態形成に関与する種々の細胞に対して、複数の分子作用機序を介して免疫および炎症性反応を抑制し、抗RA作用を発揮すると考えられています。日本リウマチ学会、米国リウマチ学会(ACR)、欧州リウマチ学会(EULAR)のガイドラインではMTXが第1選択薬として推奨されています。 わが国においては、RAに対するMTXはこれまで経口薬のみが発売されていましたが、本剤は週1回の皮下投与のプレフィルドシリンジです。医師の管理・指導のもと、自己注射も可能です。2022年9月時点で、本剤は欧州を中心に世界49の国または地域で承認されており、2019年には欧州医薬品庁はMTXの誤投与の危険性を回避するため、RAなどの治療に対して週1回投与のMTX皮下注製剤を推奨しています。 MTX経口薬から切り替えの際の投与初期量は、1週間当たりの投与量を対比させた添付文書の表などを参考に決定されます。 安全性プロファイルは、注射部位反応を除いてMTX経口薬と同様と考えられています。主な副作用は白血球数減少、肝機能障害、悪心、口内炎などであり、重大な副作用である骨髄抑制、感染症、結核、劇症肝炎、肝不全、急性腎障害、尿細管壊死、重症ネフロパチー、間質性肺炎、肺線維症、出血性腸炎などに注意する必要があります。 悪心については、国内第Ⅲ相臨床試験(パート1)において、本剤群は 3.8%(52 例中 2 例)、MTX 経口群は 12%(50 例中 6 例)と、本剤群の方が少ない傾向がありました。このため経口薬で消化器症状出現で困っている患者さんには、使いやすそうです。 2020年10月の「医療安全情報No.167」では、MTXの過剰投与による骨髄抑制の事故が後を絶たないことについて注意喚起しています。本剤の普及によって医療現場での投与過誤、あるいは患者さんの服用過誤が減少することを期待します。
| ||
| 8. 製造販売元など | ||
| 製造販売元:日本メダック株式会社 販 売 元:エーザイ株式会社 お問合せ先:エーザイ株式会社 hhcホットライン 0120-419-497 更新 2023.05.03 イラスト説明文加筆 更新 2023.06.18 添付文書へのリンク 更新 2023.06.29 消化器症状について加筆 |
(文責 下平秀夫) 2023年3月/2023年6月更新


